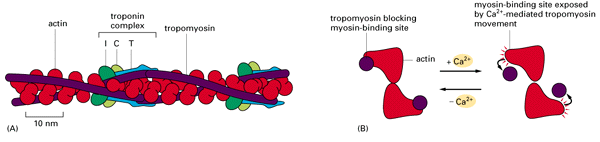
Os filamentos de actina e miosina têm uma grande afinidade e ligam-se facilmente sem a presença do complexo troponina/tropomiosina. Nota-se que esse complexo impede a ligação na ausência de Ca2+. O mecanismo de liberação do sítio de ligação actina/miosina começa com a chegada do potencial de ação à membrana do músculo, promovendo a entrada maciça de íons Ca2+ . Estes íons ligam-se à troponina C, causando uma mudança conformacional da mesma que se reflete na molécula de tropomiosina, que libera então os sítios da actina que estavam bloqueados. A interação actina/miosina se dá imediatamente desde que haja ATP e magnésio (ambos presentes em condições normais).
